La vitrectomía (VPP) es el procedimiento quirúrgico por el cual se extrae el gel vítreo del interior de la cavidad ocular. Dicha técnica tiene una doble utilidad en uveítis, por una parte ayuda al diagnóstico etiológico del la misma (VPP diagnóstica) y por otra puede mejorar la agudeza visual y pronóstico visual del paciente (VPP terapéutica).
Las VPP diagnósticas se pueden dividir en 2 categorías: sospecha de linfoma o malignidad y sospecha de infección. La sensibilidad de la misma difiere según los estudios entre un 20 y un 92% (1). La discrepancia entre los estudios se atribuye a la heterogenicidad de la muestra, las diversas definiciones para el diagnóstico final así como la posibilidad del tratamiento inadecuado de la muestra. Manisha Metha et al (2) revisan 5736 vitrectomías de 3 centros de referencia concluyendo que se trata de una prueba útil para el diagnósico diferencial entre malignidad, infección e inflamación pero que requiere de una sospecha clínica previa y una adecuada comunicación con el patólogo para optimizar los test a realizar sobre una muestra de un fluido escaso como es el vítreo. A su vez emiten unas recomendaciones para el procesado de las mismas (Tabla 1).
Así pues, cuando un paciente no responde al tratamiento con esteroides sospechando infección o malignidad, la vitrectomía contribuye al diagnóstico en el 20-60 % de los casos, siendo superior a la muestra de humor acuoso de cámara anterior que es contributiva en un 30% de los casos. (3)
Indicaciones
Las principales indicaciones en uveítis son:
- Uveítis crónica de causa desconocida con presentación atípica, pruebas poco concluyentes o mala respuesta al tratamiento.
- Sospecha de síndrome mascarada secundario a neoplasia intraocular.
- Sospecha de endoftalmitis infecciosa de causa no filiada.
Dificultades
El tratamiento de la muestra vítrea es delicado dada la paucicelularidad vítrea, la estructura gelatinosa del vítreo y la baja frecuencia de biopsias vítreas frente a biopsias de órganos. Es necesario un anatomopatólogo entrenado para la interpretación de las mismas, un cirujano de retina experto así como una adecuada comunicación entre ellos y correcto transporte de la misma. Debido a que en muchas ocasiones se maneja inadecuadamente, la tasa de falsos negativos puede ser frecuente. Además, los procesos malignos como los linfomas intraoculares atraen linfocitos reactivos y los pacientes con uveítis son tratados con frecuencia con corticoides, con cierto papel tumoricida.
Técnica
El objetivo de la VPP en ojos con sospecha de neoplasia o infección es obtener la mayor cantidad de vítreo no diluido posible. La vitrectomía básica incluye los siguientes pasos:
- Se inserta una cánula de infusión (3,5 mm detrás de limbo en ojos pseudofáquicos y afáquicos y 4 mm en ojos fáquicos) a nivel del borde inferior del músculo recto lateral; se requiere una peritomía (disección conjuntival) límbica para los sistemas convencionales de gran calibre, pero no si se usan calibres pequeños.
- Se practican otras esclerotomías en las posiciones horarias de las 10 y las 2, a través de las cuales se introducen el vitreotomo y la sonda de fibra óptica que nos ilumina el interior del globo ocular. Estas esclerotomías son autosellables con los sistemas modernos de calibres pequeños (25-27 G), aunque en los casos de uveítis se recomienda la sutura de las mismas dado que la hipotonía postoperatoria podría exacerbar la inflamación.
- Se elimina el gel vítreo central y la superficie hialoidea posterior según la cantidad de vítreo que se desee eliminar.
Concretamente para la vitrectomía diagnóstica, se procura obtener una muestra inicial no diluida (al menos 1-1.5 ml) antes de abrir la infusión, con una jeringa de 3 ml conectada a la línea de aspiración del vitreotomo hasta que el ojo se comienza a notar hipotono. Se procurará mantener bajo el corte del mismo para conservar la máxima integridad celular (600 cpm). Aunque algunos estudios aseguran que el corte vítreo no parece causar más degeneración celular comparado con la aspiración simple (4), se procurará mantenerlo bajo dado que se han descrito tasas más elevadas de diagnóstico de linfoma vitreoretiniano con cortes y aspiración bajos (5). En ese momento se inicia la infusión pudiendo aspirar vítreo diluido en una segunda jeringa. Quiroz-Mercado et al han descrito la posibilidad de vitrectomía bajo perfluorocarbono en la cual la solución salina equilibrada se sustituye con perfluorocarbono durante la aspiración vítrea siendo capaces de obtener con este método una media de 2.24 ml de vítreo no diluido (6). Otra técnica descrita para prevenir la hipotonía es la biopsia vítrea bajo aire (7). Generalmente con VPP 25 G usando aire como la única perfusión. La pieza de mano se conecta directamente a una jeringa de 10 ml. Mientras el cirujano controla el corte y la posición, un ayudante aspira manualmente en vítreo pudiendo realizar una VPP central o completa de esta manera usando solo infusión con aire para mantener la presión ocular. Esta técnica es menos problemática en ojos pseudofáquicos con cápsula posterior íntegra.
Otra opción para obtener muestra vítrea con la ventaja de ser una técnica ambulatoria sería la aspiración vítrea con aguja de 23-30 G. La cantidad aspirada suele ser de 0,1-0,5 ml lo que limita la cantidad de muestra. Otro inconveniente es el riesgo de tracción vítreoretiniana.
Análisis de la muestra
- Tinciones y cultivo. Para diagnosticar infección las muestras se envían de forma rutinaria para tinción Gram, cultivo (aeróbico, anaeróbico y fúngico) y antibiograma. Algunos autores abogan por la inoculación inmediata en el medio de cultivo apropiado por el propio cirujano. Muchos organismos detectados en las endoftalmitis crónicas son de crecimiento lento por lo que hay que indicar al microbiólogo la necesidad de mantener los cultivos durante al menos 2 semanas. La sensibilidad es en torno al 40-70% pudiendo aumentar al 88% si se requiere vitrectomía (8). El vítreo diluido se puede pasar por filtros Millipore para aumentar la concentración de células y microrganismos.
- Reacción en cadena de la polimerasa (PCR). Para la detección de virus de la familia herpes pero también en casos de presunta tuberculosis ocular, Toxoplasma gondii junto con el cociente GW y otros patógenos (protozoos, hongos). También se utiliza la PCR para la detección de blc-2 y reordenamiento de cadenas pesadas en la sospecha de linfoma intraocular.
- Análisis citopatológico.
- El método gold estándar para detectar linfoma en la muestra vítrea suele ser el transporte rápido de la misma sin fijar y análisis por el patólogo. Pero es confuso dada la presencia de células reactivas inflamatorias, células necróticas y fibrina. El punto crucial es la distinción entre linfocitos inflamatorios y linfoma, en particular cuando sólo llegan un pequeño número de células intactas. Las células B malignas presentan características demostrables usando tinción Giemsa, Papanicolau o Diff Quiz (9). Presentan un gran núcleo oval o redondeado con frecuencia segmentado o con nucléolo prominente rodeado por un escaso citoplasma basófilo. La sensibilidad varía entre 31 y 67 %, siendo mayor en los casos de linfoma que en la enfermedad metastásica (9). Dado que la muestra de vítreo no diluido es escasa y delicada se han desarrollado otras técnicas como el bloque celular usando vítreo diluido, lo cual permite analizar muestra vítrea de células próximas a la retina y no sólo del vítreo central.
- La citometría de flujo permite analizar simultánemanete varios marcadores diferentes de la superficie celular y demostrar la monoclonalidad. El vítreo diluido se centrifuga y se resuspende en medio de cultivo celular. Las células se cuentan y se tiñen con anticuerpos para detectar marcadores que identifican leucocitos, linfocitos T, linfocitos B, monocitos / macrófagos y activación de linfocitos. Presenta una sensibilidad en torno al 83% para detección de linfoma intraocular (10).
- Análisis molecular. La microdisección y la PCR pueden ser de apoyo para diagnosticar el linfoma intraocular. La microdisección permite la selección y el análisis molecular de células linfoides malignas o atípicas de muestras vítreas con pocas células o mal conservadas que no hayan sido diagnósticas mediante técnicas citológicas de rutina. Utilizando PCR, la amplificación de los genes de la cadena pesada de la inmunoglobulina de células B es útil para analizar reordenamientos clonales, marcadores moleculares de clonalidad y translocaciones de bcl-2 que promueven la supervivencia celular y predicen un curso tumoral más agresivo.
- Determinación de anticuerpos: ELISA. Goldmann-Witmer (GW).
- ELISA: Se utiliza vítreo no diluido para detectar anticuerpos contra virus varicela zóster, virus herpes simple, citomegalovitus, virus Epsteina Barr, Toxoplasma y Toxocara.
- Cociente GW: se emplea para determinar la producción local de anticuerpos. Se calcula dividiendo el cociente de IG especifica vítrea/IG total vítrea entre IG específica sérica/IG total sérica. Un cociente de 3 o mayor indica producción local de anticuerpos.
- Análisis de citoquinas. Las células B malignas pueden secretar altos niveles de IL-10 (citoquina inmunosupresora) mientras que las uveítis inflamatorias se asocian a altos niveles de IL- 6 (citoquina proinflamatoria). Esto provoca que un ratio IL-10/IL-6 > 1 sea sugestivo de linfoma. Dicho cociente presenta una sensibilidad que varía entre el 70% y el 90 % según los estudios recientes (11,12). Se trata de un método complementario de sospecha que precisa otros test para corroborar el diagnóstico dado que se han descrito casos de linfomas con altos niveles de IL-6 y de uveítis no mascarada con altos niveles de IL-10.
Complicaciones
Entre las complicaciones postoperatorias, una de las que más preocupa es el desprendimiento de retina, variando desde el 0% al 42 % según los estudios (13). Parece que la biopsia coriorretiniana aumenta el riesgo. Podría disminuirse dicho riesgo usando endodiatermia para marcar previamente y para coagular tras la biopsia. Después se rodea la zona con endoláser para asegurar los bordes de la retinotomía (14).Por otra parte, la vitrectomía con microincisión en uveítis (23-25 G frente a 20 G) se ha demostrado segura y eficaz, con menor incidencia de roturas iatrogénicas.
Otras complicaciones serían la progresión de catarata, hipotonía, sangrado, infección o formación de membrana epirretiniana.
Vitrectomía Terapéutica
El mecanismo por el cual la vitrectomia mejora la inflamación no está del todo claro. Parece que la retirada del vítreo elimina mediadores y células inflamatorias (incluyendo inmunocomplejos y citoquinas) así como la carga de antígenos infecciosos.
Se ha visto además que la VPP disminuye la necesidad de terapia inmunosupresora llegando incluso a demostrar superioridad a la inmunosupresión en términos de mejoría de AV y disminución de la vitritis (15). También mejora el edema macular.
En el caso de uveítis infecciosa se procede a la inyección de antibióticos, antifúngicos o antivirales en el momento quirúrgico. También se puede asociar a la inyección de corticoide intraocular según el caso (vídeos anexos 1 (VITRECTOMIA Y OZURDEX EN PARS PLANITIS y 2 INYECCIÓN DE OZURDEX TRASVITRECTOMIA)
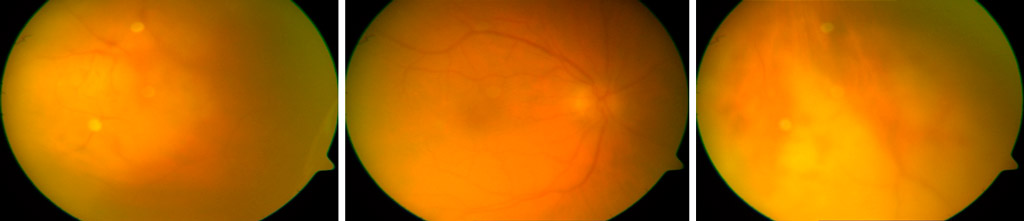
Mujer de 73 años diagnosticada de necrosis retiniana aguda por VHS-1; se instaura tratamiento con Aciclovir endovenoso y prednisona oral en dosis descendentes.

Al disminuir la dosis de prednisona a se aprecia aumento de vitritis motivo por el que se indica Vitrectomía terapéutica.
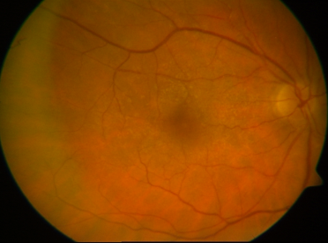
Aspecto del fondo de ojo tras vitrectomía.
Mención especial merecen las uveítis intermedias pediátricas donde puede ser especialmente eficaz una VPP relativamente precoz particularmente en ojos con edema macular. Ésta, además de eliminar carga inmunológica, elimina adhesiones patológicas vitreoretinianas y desprende la hialoides posterior lo cual mejora el edema macular y por tanto la agudeza visual. Además disminuye el número de recidivas y la necesidad de medicación (16).
Otras indicaciones en uveítis: edema macular reclacitrante, opacidad de medios, desprendimiento de retina asociado, membrana ciclítica que causa hipotonía, membrana epirretiniana, control de la inflamación, endoftalmitis.
|
Lymphoma |
Lymphoma |
Autoimmune Inflamatory |
Tumor Metastasis |
|
|---|---|---|---|---|
|
Undiluted vitreous |
|
PCR: Toxoplasma Gondii, HSV, VZV, TB complex, CMV |
|
Cytologic analysis (PAP, Diff Quik stain) |
|
Diluted vitreous |
Cell block preparation for cytologic analysis (HE and PAS stains) and immunohistochermistry (CD20, CD3, in situ hybridization of kappa and lambda chains and EBV) |
|
Cell block preparation for cytologic analysis and immunohistochemistry |
BIBLIOGRAFIA:
-
Wittenberg LA, Marbeley DA, Ma PE, et al. Contrinution of vitreous cytology to final clinical diagnosis: fifteeen-year review of vitreous citology specimens from one institution. Ophthalmology 2008; 115: 1944-1950.
- Mehta M, Rasheed RA, Duker J, et al. Vitreous evaluation: a diagnostic challenge.Ophthalmology. 2015;122(3):531-537.
- Grumet P, Kodjikian L, de Parisot A, et al. Comtribution of diagnostic tests for the etiological uveítis, data from the ULISSE study (Uveitis: Clinical and medicoeconomic evaluation of a standardized strategy of the etiological diagnosis. Autoimmun Rev. 2018 Apr;17(4):331-343
-
Conlon MR, Craig I, Harris JF, et al. Effect of vitrectomy and cytopreparatory techniques on cell survival and preservation. Can J Ophthalmol 1992; 27:168-171
-
Jiang T, Zhao Z, Chang Q. Evaluation of cytologic specimens obtained during experimental vitreous biopsy using B-cell lymphoma line. Eur J Ophthalmol 2014; 24: 911-917.
-
Quiroz-Mercado H, Rivera- Sempetegui J, Macky TA, et al. Performing vitreous biopsy by perfluorocarbon-perfused vitrectomy. Am J Ophthalmol 2005; 140: 1161-1163.
- Mura M, Buschini E, Iannetta D, et al. Vitreous Biopsy Under Air. Retina. 2016 Apr;36(4):838-9.
-
Davis JL, Miller DM, Ruiz P. Diagnostic testing of vitrectomy specimens. Am J Ophthalmol 2005; 140: 822-829.
- Van ginderdeuren R. Van Calster J, Stalmans P, et al.A new standardized method to simple and analyse vitreous samples by the Cellient automated cell block system. Acta Ophthalmol. 2014 Aug;92(5):e388-92.
-
Margolis R, Brasil OF, Lowder CY, et al. Vitrectomy for the diagnosis and management of uveítis of unknow cause. Ophthalmology 2007; 114: 1893-1897
-
Fisson S, Ouakrim H, Touitou V, et al. Cytocine profile inhuman eyes: contribution of a new cytokine combination for differential diagnosis between intraocular lymphoma or uveítis. PLoS One 2013; 8:e52385.
-
Mehta M, Rasheed RA, Duker J, et al. Vitreous evaluation: a diagnostic challenge. Ophthalmology 2015; 122: 531-537
- Zhao XY1, Xia S, Chen YX. Role of diagnostic pars plana vitrectomy in determining the etiology of uveítis initially unknow. Retina. 2018 Oct 23. doi: 10.1097/IAE.0000000000002372.
-
Lim L, Suhler E, Rosenbaum J, Wilson D. The role of choroidal and retinal biopsies inthe diagnosis and management of atypical presentations of uveítis. Trans Am Ophthalmol Soc 2005; 103: 84-91
-
Quinones K, Choi JY, Yilmaz T, et al. Pars plana vitrectomy versus immunomodulatory therapy for intermediate uveítis: a prospective, randomized pilot study. Ocul Immunol Inflamm 2010; 18: 411-417.
- Darsová D, Pochop P, Štěpánková J, et al. Long-term results of pars plana vitrectomy as an anti-inflammatory therapy of pediatric intermediate uveitis resistant to standard medical treatment. Eur J Ophthalmol. 2018; 28(1):98-102.
